Nieodłącznym elementem wyposażenia każdego płetwonurka – rekreacyjnego czy też technicznego – jest butla nurkowa. Jest ona używana w każdej możliwej konfiguracji sprzętowej niezależnie od tego, czy jest to obieg otwarty czy zamknięty. Ten jakże istotny element sprzętu nurkowego zapewnia nam niezbędny zapas czynnika oddechowego do przebywania pod wodą przez określoną ilość czasu. Oczywiście my chcielibyśmy żeby czas ten był jak najdłuższy. Producenci odpowiadając na potrzeby płetwonurków dostarczali na rynek butle o coraz większych pojemnościach. Nurkowie z kolei łączyli je w zestawy znane wszystkim jako twinsety. Jednak duża butla (lub butle) na plecach to nie tylko same zalety. To również większy ciężar do dźwigania, większe wymiary oraz problemy z transportem na nurkowisko czy nieporęczność przy poruszaniu się. O ile więc nurek nie jest w stanie wydać sporych pieniędzy na sprzęt do nurkowania na obiegu zamkniętym, skazany jest na mocno ograniczony czas pobytu pod wodą. Ten z kolei – w miarę naszych postępów nurkowych – jest coraz krótszy ponieważ nurkujemy coraz głębiej lub dalej.
Butle 300-barowe – zalety.
Rynek jednak nie znosi próżni i dla użytkowników obiegów otwartych pojawiła się jeszcze jedna opcja którą mogą wykorzystać. Od dłuższego czasu ogólnie dostępne są butle nurkowe przystosowane do pracy pod ciśnieniem 300 bar zamiast standardowych 200 bar. Rozwiązanie takie ma kilka istotnych zalet. Przede wszystkim większe ciśnienie oznacza większy zapas gazu w butli bez konieczności powiększania jej objętości. Fakt ten sprawia, że rozwiązanie takie jest bardzo korzystne dla osób mniejszej postury, które nie chcą dźwigać na plecach wielkich i nieporęcznych zestawów lub duże butle uniemożliwiają im poruszanie się w ograniczonych przestrzeniach (np. wewnątrz wraku). Kolejną zaletą 300 barowych butli jest ograniczenie zabieranego ze sobą balastu. Z konieczności pracy przy dużo większym ciśnieniu, butle 300 barowe muszą mieć grubszy płaszcz niż ich standardowe odpowiedniki o takich samych objętościach. Różnica ta wpływa więc na ich masę całkowitą. Standardowa 12-litrowa butla nurkowa waży około 14 kg, z kolei jej wytrzymalsza siostra o tej samej objętości ma masę aż 17 kg. Różnica ta pozwala nam na znaczne ograniczenie przyczepianego do zestawów balastu, a rozłożony na większej powierzchni ciężar umożliwi nam łatwiejsze wytrymowanie się.
Butle 300-barowe – wady.

Jedyną wadą – oczywiście oprócz ceny – takiego rozwiązania jest ich kompatybilność sprzętowa. O ile nie ma na tym polu problemów z automatami oddechowymi (praktycznie wszystkie I stopnie z połączeniem typy DIN dostępne na rynku są przystosowane do pracy pod ciśnieniem 300 bar), to znalezienie sprężarkowni która posiada urządzenia zdolne nabić taki zbiornik może stanowić pewną trudność. Duże centra i bazy nurkowe w większości posiadają odpowiedni sprzęt. Jednakże nabijanie butli do takiego ciśnienia przy użyciu przenośnych sprężarek lub na mniej popularnych akwenach jest praktycznie niemożliwe.
(Na obrazku: Oznaczenie „300 bar” na I stopniu z gwintem typu DIN.)
Czy „300 bar” oznacza więcej?
Mimo to z takiego rozwiązania korzystają setki płetwonurków na całym świecie. Wielu, jako główny powód ich decyzji podaje pierwszą z wymienionych zalet. Większy zapas czynnika oddechowego w porównaniu do butli o takiej samej pojemności nabijanych do standardowych 200 bar jest solidnym argumentem. Ale czy ten zapas jest rzeczywiście tak znacznie większy? Aby to sprawdzić należy dokładniej przyjrzeć się właściwościom gazu który jest sprężany. Jako obiekt rozważań przyjmijmy tutaj powietrze, gdyż jest to obecnie najpopularniejsza mieszanka oddechowa wykorzystywana w nurkowaniu (i raczej się to nie zmieni).
Czym właściwie jest gaz?
Gaz jest to oczywiście stan skupienia materii w którym to cząsteczki poruszają się swobodnie w dowolnym kierunku. Pomiędzy tymi cząsteczkami nie zachodzą żadne silne oddziaływania ani relacje poza tym, iż zderzają się one ze sobą. Dodatkowo jeśli gaz zamknięty jest w szczelnym naczyniu, to cząsteczki oprócz wzajemnych zderzeń uderzają również w ścianki naczynia. Te uderzenia wywierają na naczynie określone ciśnienie, które my możemy odczytać z manometru. Rysunek po prawej stronie przedstawia schemat ilustrujący zachowanie się cząsteczek gazu w zamkniętym naczyniu.
Gaz doskonały i równanie Clapeyrona.
Powyższy opis jednakże dotyczy tzw. gazu doskonałego (inaczej idealnego). Jest to pewnego rodzaju uproszczony model, który pozwala z dużym przybliżeniem na opisywanie zjawisk dotyczących gazowego stanu skupienia. Modele takie są szeroko stosowane w fizyce i chemii w celu bardziej przejrzystego opisu wszelakich zasad i procesów za pomocą opisu tekstowego lub wzorów matematycznych. Gaz jako stan skupienia możemy opisać czterema głównymi parametrami: ilością cząsteczek gazu (podawaną w jednostkach zwanych molami), zajmowaną przez tą ilość objętością, temperaturą oraz ciśnieniem. Wszystkie te miary są zależne od siebie, a ich wzajemne zależności opisuje równanie Clapeyrona przedstawione poniżej.

Zależność ta jest podstawą wielu fundamentalnych praw wykorzystywanych w nurkowaniu m.in. poznawanemu już na kursie podstawowym prawu Boyle’a – Martiotte’a. Odpowiednio przekształcając równanie Clapeyrona możemy obliczyć ile gazu znajduje się w naszej butli nurkowej. Wystarczy odczytać wskazania naszego manometru i znać objętość butli, z którą będziemy nurkować. Mnożąc obie te wartości w prosty sposób obliczamy zapas naszego czynnika oddechowego na nurkowanie. Jest to bardzo przydatna umiejętność, gdyż znając własne powierzchniowe zużycie powietrza (ang. SAC – Surface Air Consumption) możemy obliczyć ile czasu będziemy mogli spędzić pod wodą na danej głębokości. Takich obliczeń uczy się każdy nurek już na kursie podstawowym więc nie będziemy ich tutaj rozwijać.
Model (nie)doskonały?
Można powiedzieć, iż wszystko wygląda bardzo pięknie. Istnieją przykłady modelowe gazu i wzory do jego opisu. Potrafimy obliczać zależności pomiędzy najważniejszymi parametrami gazów i wyliczać z tych parametrów najpotrzebniejsze dane. Skąd więc pojawiające się wątpliwości? Otóż stosowane w nauce wzorce modelowe, nawet jeśli doskonale opisują obserwowane przez nas zjawiska, są jedynie przybliżeniem otaczającego nas rzeczywistego świata. Można to porównać do pary zakochanych która, w romantycznej powieści opisywana jest jako dwoje kochających się ludzi, a przecież w rzeczywistości ich relacjom towarzyszy wiele innych dodatkowych uczuć i zdarzeń. Tak samo ma się idea gazu doskonałego do gazu istniejącego w rzeczywistości.
Zderzenie z rzeczywistością…
Przypomnijmy, iż gaz idealny to taki, w którym pomiędzy cząsteczkami nie zachodzą żadne oddziaływania (przyciąganie/odpychanie) oraz rozmiary tych cząsteczek są nieskończenie małe. W prawdziwym życiu obie te reguły są złamane – relacje między cząsteczkami występują, a cząsteczki posiadają określone wymiary. Dlaczego więc, skoro wiadomo o tych parametrach, pomija się je w ogólnym modelu? Są dwa główne powody. Pierwszy mówi, iż zarówno oddziaływania międzycząsteczkowe, jak i rozmiary samych cząsteczek są to wartości bardzo niewielkie. Są tak małe i nieistotne, iż w praktyce wręcz niezauważalne w – tutaj kluczowa część zdania – pewnych zakresach ciśnienia i temperatury, przede wszystkim w tych jakie występuje na ziemi naturalnie. Drugi powód przedstawiono poniżej. Jest to również równanie opisujące zależności parametrów gazu, ale tym razem gazu rzeczywistego.
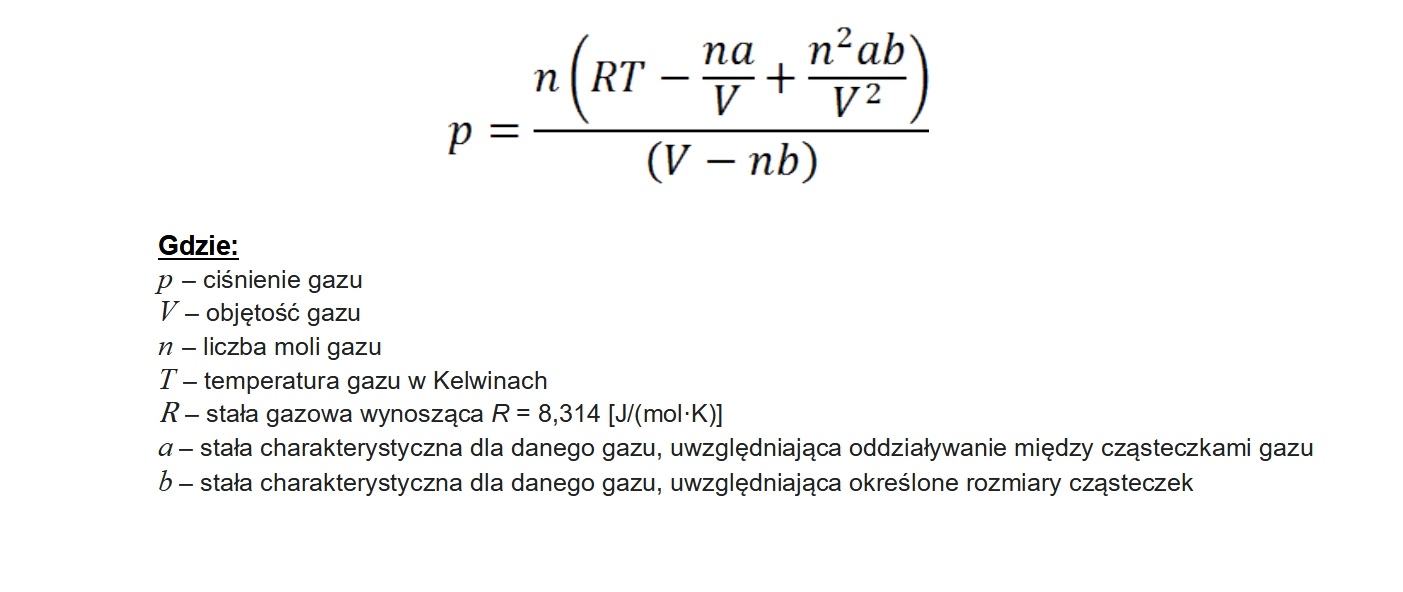
Prawda, że piękne? Wzór ten nosi nazwę równania van der Waalsa i opisuje dokładnie te same zależności co równanie Clapeyrona. Różnica polega na tym że, tutaj uwzględnione są już wspomniane wcześniej oddziaływania między cząsteczkami gazu i rozmiary tych cząsteczek. Udowodnić to można w bardzo prosty sposób. Wystarczy za parametry a i b wstawić „0” (czyli inaczej mówiąc pominąć je), a równanie van der Waalsa przekształci się w równanie Clapeyrona.
Co tak naprawdę dzieje się w tej butli?
Dlaczego jednak o tym mówimy? Otóż, napełniając butle czynnikiem oddechowym sprawiamy, iż zwiększa się ciśnienie znajdującego się w niej gazu. Fakt ten powoduje, iż cząsteczki gazu znajdują się coraz bliżej siebie, przez co zaczynają coraz mocniej na siebie oddziaływać i mieć coraz mniej przestrzeni – bo przecież mają one (cząsteczki) jakieś wymiary i jest ich coraz więcej! O ile przy napełnianiu zbiorników ciśnieniowych do standardowych 200 bar te oddziaływania nie mają, aż takiego znaczenia (dlaczego tak jest wyjaśni się nieco później), o tyle przy 300 barach ma to spory wpływ na ogólną sytuację wewnątrz butli. Dużo łatwiej będzie zrozumieć to na wykresie. Jako przykład przyjmijmy, iż napełniano dwa jednakowe 24 litrowe (2×12) twinsety, jeden do ciśnienia 200 bar, natomiast drugi do ciśnienia 300 bar. Na podstawie wzorów Clapeyrona (gaz doskonały) i van der Waalsa (gaz rzeczywisty) sporządzono zaprezentowany poniżej wykres zależności ilości litrów gazu w butli od ciśnienia panującego wewnątrz niej.
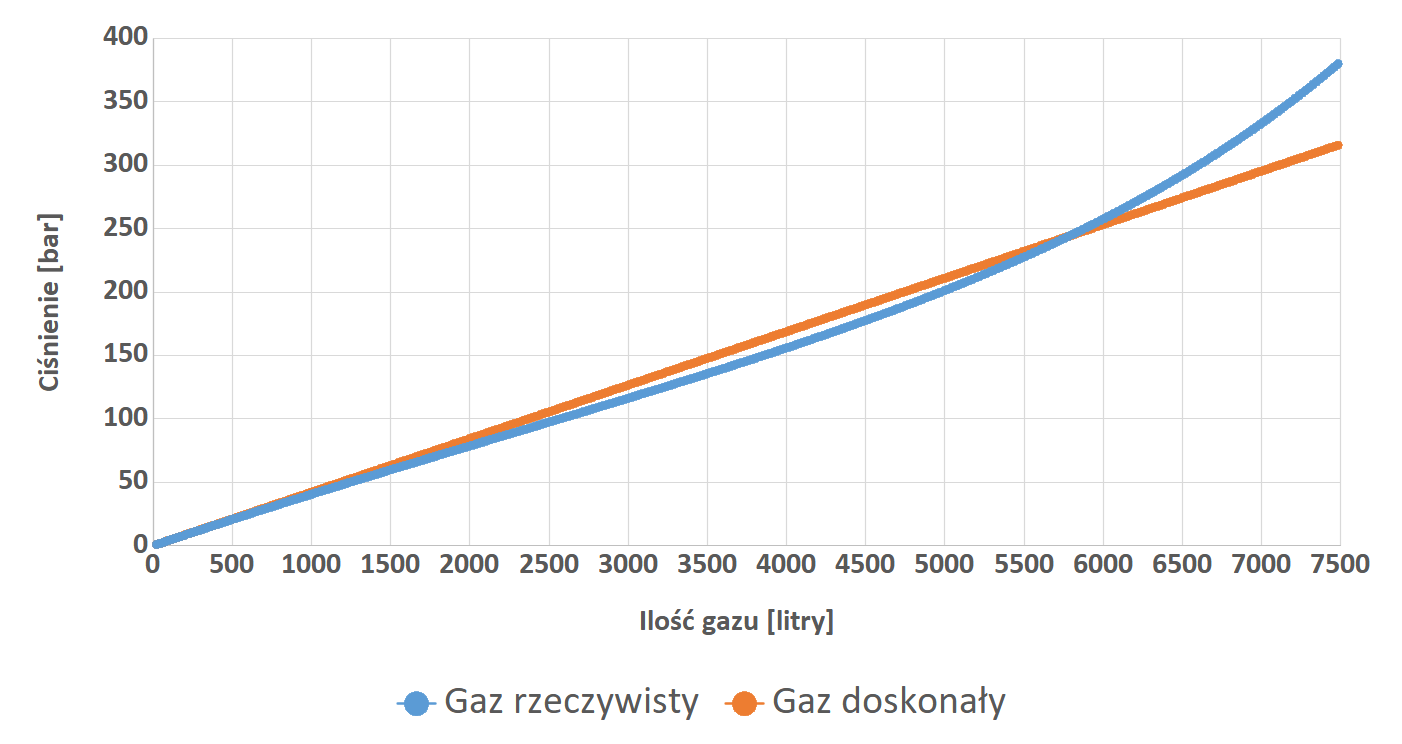
Widać wyraźnie, iż na samym początku, zależność ilości gazu w butli od ciśnienia dla obu gazów jest praktycznie identyczna. Stan taki utrzymuje się mniej więcej do wartości 100 bar i dlatego może spokojnie być opisywany równaniem Clapeyrona. Po przekroczeniu tej wartości krzywa gazu rzeczywistego nie wzrasta już tak szybko jak krzywa gazu doskonałego. Za fakt ten podpowiadają niewielkie (jeszcze w tym momencie) oddziaływania międzycząsteczkowe, które powodują, iż pomimo ciągłego wzrostu ilości cząsteczek gazu w butli, ciśnienie gazu nie wzrasta znacząco. Mówiąc prościej, cząsteczki gazu są „upychane” w butli i jest tam jeszcze tyle miejsca, iż przychodzi to z łatwością. Sprawa zaczyna wyglądać nieco inaczej przy przekroczeniu ciśnienia 230 bar. Widzimy wyraźnie, iż pomimo dużego wzrostu ciśnienia w butli, ilość cząsteczek gazu wzrasta znacząco wolniej. W tym właśnie momencie, siły międzycząsteczkowe zaczynają odgrywać istotną rolę w mechanice gazu i sprawiają, iż równanie Clapeyrona zaczyna tracić sens, a wykorzystywać należy równanie van der Waalsa.
200 bar, a 300 bar jak duża to różnica?
Interesujący natomiast jest fakt, iż obie krzywe przecinają się w okolicach wartości ciśnienia 220 bar. Czyżby właśnie to determinowało wybór takiej liczby na wartość ciśnienia pracy większości butli nurkowych? Całkiem możliwe, iż miało to wpływ na tą decyzje. Z pewnością jednak właśnie z tego powodu w nurkowaniu do obliczeń możemy z powodzeniem używać mniej skomplikowanego równania Clapeyrona. Wróćmy jednak do naszego wykresu. Dla większej czytelności i zrozumienia zamieszczę go poniżej raz jeszcze z dodatkowym opisem w postaci strzałek z wartościami oznaczającymi ilość litrów gazu.
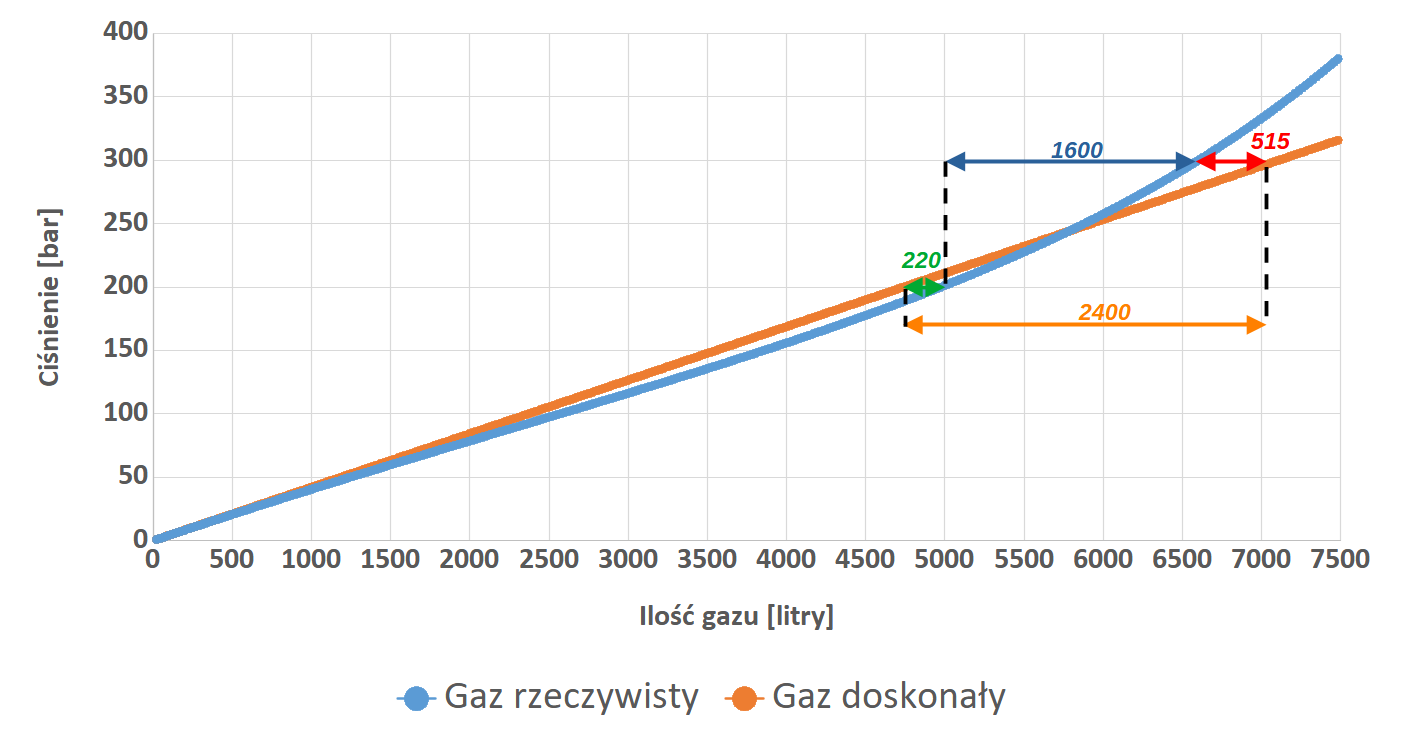
Teoretycznie (pomarańczowa krzywa – przyp. autora) nabijając nasz zestaw do 300 bar zamiast do 200 bar mielibyśmy w nim o 2400 litrów gazu więcej (pomarańczowa strzałka). Całkiem niezły wynik prawda? Taka ilość gazu pozwala nurkowi o SAC na poziomie 20 l/min na oddychanie na głębokości 40 metrów przez 23 minuty! To baaardzo dużo czasu…
A jak jest naprawdę? Czas porównać oba wykresy. Dla wartości ciśnienia 200 bar, a więc wykorzystywanego przez większość nurków, różnica w zgromadzonej ilości gazu pomiędzy modelem doskonałym (pomarańczowa krzywa), a rzeczywistym (niebieska krzywa) wynosi około 220 litrów na niekorzyść modelu doskonałego (zielona strzałka), a więc możemy powiedzieć, iż mamy w butli troszkę więcej gazu niż byśmy oczekiwali. Z kolei dla ciśnienia 300 bar porównując model doskonały i rzeczywisty (czerwona strzałka), obliczenia pokazują, iż spodziewamy się mieć w zapasie o 515 litrów gazu więcej niż jest w rzeczywistości. A tak naprawdę, te 100 barów gazu sprawi, iż nasz zapas czynnika oddechowego zwiększy się jedynie o 1600 litrów (niebieska strzałka)…
Krótkie podsumowanie.
Rozważając zatem wybór butli 300 barowej, warto zastanowić się nad wszystkimi korzyściami i wadami takiego rozwiązania. Nie tylko patrząc na to tylko przez pryzmat ergonomii zestawu, ale również ekonomii gazów. Zwłaszcza, że w tak ekstremalnych ciśnieniach ich rzeczywiste właściwości znacznie różnią się od tych modelowych.

O autorze:
Daniel Popławski to doświadczony IDF Master Diver Instructor pochodzący z Mazur. Jest autorem wielu prezentacji szkoleniowych używanych przez instruktorów IDF. Z wykształcenia chemik, Daniel wykorzystuje swoją wiedzę w bardziej ścisłych aspektach związanych z nurkowaniem, jak chociażby gas blending. Prywatnie fan zdrowego trybu życia i wszelkiej aktywności fizycznej związanej głownie z wodą (niekoniecznie w stanie ciekłym). Swoim odpowiedzialnym i entuzjastycznym nastawieniem zaraża nowych adeptów nurkowania.




